Das System verwendet papierlose Recorder von Yokogawa, die den Anforderungen der ‚Good Manufacturing Practice‘ (GMP1), des Qualitätsmanagementsystems (QMS2) und anderen behördlichen Vorschriften entsprechen; sie können an verschiedenen Standorten in der Prozessanlage installiert werden. Das EMS minimiert Risiken und unterstützt die Hersteller von pharmazeutischen und medizinischen Produkten bei der Durchführung einer strengen und effizienten Umgebungsüberwachung; es gewährleistet so die Einhaltung der verschiedenen Vorschriften und Richtlinien für Betriebsabläufe in Produktionsstätten.
Entwicklungshintergrund
In Fertigungs-, Prüf- und Lagerbereichen pharmazeutischer und medizintechnischer Anlagen muss die Aufzeichnung und Verwaltung von Umgebungsdaten wie
- Temperatur
- Feuchte
- Raumdifferenzdruck und
- Partikelzahl
in Übereinstimmung mit GMP-, QMS- und anderen Vorschriften erfolgen, die die Richtigkeit, Vollständigkeit, Aktualität und sichere Speicherung dieser Daten gewährleisten sollen3. Nur mit einem einheitlichen Ansatz lässt sich die Verwaltung von Umweltdaten rationalisieren, die an mehreren Standorten in einer Fertigungsanlage gemessen werden. Die Datenerfassung und -speicherung kann theoretisch zwar durch ein Allzwecküberwachungs- und -steuerungssystem erfolgen, doch müsste ein solches System so konfiguriert werden, dass es die behördlichen Anforderungen verschiedener Branchen erfüllt. Ein solches System birgt zudem Probleme beim Risikomanagement, da die Daten direkt von den Sensoren erfasst werden. Dabei würde jede Art von Ausfall wie z.B. ein Stromausfall, eine Fehlfunktion der Sensoren oder ein Überschreiten der Recorderkapazität einen größeren Datenbereich beeinträchtigen. Um diese Probleme zu lösen, hat Yokogawa das Umweltüberwachungssystem OpreX Environmental Monitoring System entwickelt.
Merkmale
- Einhaltung regulatorischer Anforderungen
Wie von der FDA in 21 CFR Teil 11 und anderen Vorschriften zu elektronischen Aufzeichnungen und Signaturen gefordert, bietet das EMS folgende Funktionen:
– Benutzerverwaltung
– Funktion, die das Überschreiben, Löschen oder Verfälschen aufgezeichneter Datendateien verhindert
– Audit-Trail-Funktion
– Zeitsynchronisation
– Funktion zur Wiederherstellung von Backups und
– Archivabfrage.
Dadurch wird sichergestellt, dass die aufgezeichneten Daten korrekt, vollständig und aktuell sind und sicher gespeichert werden.
- Datenerfassung und Langzeitspeicherung
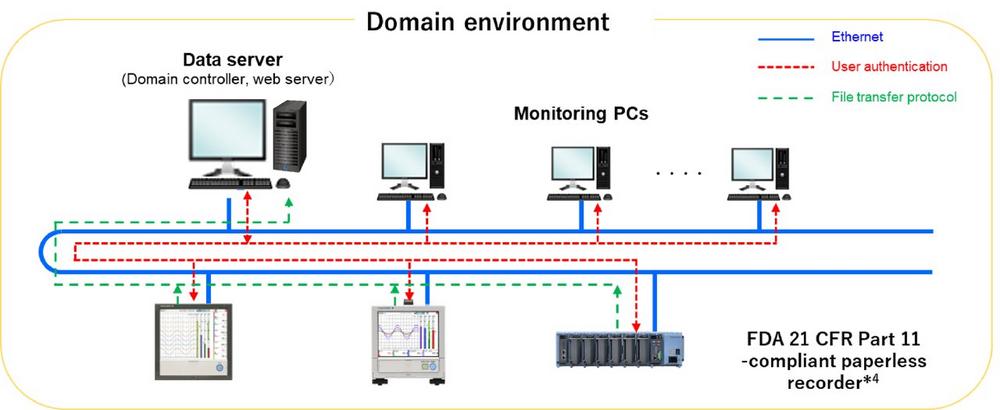
Die papierlosen Datenrecorder4 dieses Systems können an verschiedenen Standorten in einer Anlage installiert werden. Die Daten aus den Recordern werden auf einem hochsicheren Datenserver in einem Dateiformat gespeichert, das jegliche Datenmanipulation erkennt und verhindert. Zur Backup-Speicherung ist jeder Recorder mit einer SD-Kartenfunktion ausgestattet. Bei Datenanfragen von Auditoren oder anderen Personen müssen die Nutzer nur auf die entsprechende Datei zugreifen und können sie jederzeit schnell und sicher bereitstellen.
- Echtzeit-Überwachung
Wird ein Datenfehler von einem Überwachungs-PC erkannt, zeigt der PC je nach Einstellung des papierlosen Recorders eine Alarmmeldung an, gibt einen akustischen Alarm aus und/oder sendet eine entsprechende E-Mail. Darüber hinaus kann auf die von einem papierlosen Schreiber erfassten Daten von jedem Webbrowser aus zugegriffen werden.
- Computersystemvalidierung (CSV)5
Die in diesem System verwendeten papierlosen Recorder, Datenserver und Überwachungs-PCs werden vor dem Versand an den Kunden einer CSV-Bewertung unterzogen, die dem Industriestandard für die Validierung computergestützter Systeme GAMP56 entspricht.
1 Normen für die Produktion und das Qualitätsmanagement bei der Herstellung von sicheren und wirksamen Arzneimitteln. Jedes Land legt seine eigenen Vorschriften und Richtlinien fest.
2 Normen für die Produktion und das Qualitätsmanagement bei der Herstellung von sicheren Medizinprodukten und Arzneimitteln für die In-vitro-Diagnostik. Wie bei der GMP legt jedes Land seine eigenen Vorschriften und Richtlinien fest. International findet die Norm ISO 13485 „Medizinprodukte: Qualitätsmanagementsysteme – Anforderungen für regulatorische Zwecke“ Anwendung.
3 Die Verordnung zum Vollzug des Arzneimittelgesetzes (AMG) legt fest, wie Dokumente über Testergebnisse zu erstellen sind. Laut AMG müssen Testergebnisse, die Zweifel an der Wirksamkeit und Unbedenklichkeit eines Arzneimittels aufwerfen, gründlich geprüft und vollständig und korrekt dokumentiert werden. Außerdem müssen Aufzeichnungen erstellt und aufbewahrt werden, die unterstützende Informationen enthalten.
4 Die papierlosen Datenrecorder GX10, GX20, GP10, GP20 und GM10 der Produktfamilie OpreX Data Acquisition von Yokogawa sind mit einer zusätzlichen Sicherheitsfunktion ausgestattet, die den FDA-Anforderungen in 21 CFR Teil 11 über elektronische Aufzeichnungen und Signaturen sowie den Richtlinien des japanischen Ministeriums für Gesundheit, Arbeit und Soziales entspricht.
5 Prüfungen, die bei der Einführung computergestützter Systeme durchgeführt werden, um sicherzustellen, dass es keine Probleme mit der Entwicklung, dem Design, der Inbetriebnahme, dem Betrieb, der Verfügbarkeit usw. von Hardware/Software gibt.
6 Basierend auf dem GAMP®-5-Leitfaden „Risk-Based Approach to GxP Computerized Systems“ ist dies die neueste Version des GAMP-Standards (Good Automated Manufacturing Practice) für CSV-Verfahren, der von der International Society for Pharmaceutical Engineering, Inc. (ISPE) veröffentlicht wurde.
Über OpreX
OpreX ist die umfassende Marke für Yokogawas Industrieautomation (IA) und Steuerungsgeschäft. Der Markenname OpreX steht für exzellente Technologien und Lösungen, die Yokogawa durch die gemeinsame Wertschöpfung mit seinen Kunden anbieten kann, und deckt das gesamte Spektrum der IA-Produkte, Dienstleistungen und Lösungen des Unternehmens ab. Die Marke umfasst die folgenden fünf Kategorien: OpreX Transformation, OpreX Control, OpreX Measurement, OpreX Execution und OpreX Lifecycle. Das OpreX Environmental Monitoring System ist eine Lösung der Produktfamilie OpreX Data Acquisition in der Kategorie OpreX Measurement. Die Kategorie OpreX Measurement umfasst Feldgeräte und -systeme für hochpräzise Messungen, Datenerfassung und -analyse.
Mit dieser Marke stellt Yokogawa integrierte Lösungen bereit, die den Wandel und das Wachstum eines Kunden unter Berücksichtigung seiner individuellen Geschäftsbedürfnisse unterstützen.
Yokogawa unterhält ein weltweites Netzwerk von 114 Unternehmen an Standorten in 62 Ländern. Das Unternehmen hat sich seit seiner Gründung 1915 auf zukunftsweisende Forschung und innovative Produkte spezialisiert. Industriel-le Automatisierung, Test- und Messausrüstung sowie innovative Produkte wie z.B. für die Gesundheits- und Luftfahrt-technologie sind die Hauptgeschäftsfelder von Yokogawa. Mit dem Geschäftsbereich Life Innovation möchte das Unternehmen die Produktivität entlang der gesamten Wertschöpfungskette der Pharma- und Lebensmittelindustrie deutlich verbessern. Die wichtigsten Zielmärkte der industriellen Automatisierung sind die chemische und pharmazeu-tische Industrie, die Öl- und Gasindustrie, die Energieindustrie, die Eisen- und Stahlindustrie, die Zellstoff- und Papier-industrie sowie die Lebensmittelindustrie.
Etwa 200 Mitarbeiter der europäischen Yokogawa-Organisation sind an verschiedenen Produktions- und Vertriebs-standorten in Deutschland und am Sitz der Yokogawa Deutschland GmbH in Ratingen beschäftigt; rund 80 Automa-tisierungs-, Elektrotechnik- und Verfahrensingenieure arbeiten bei Yokogawa Deutschland an der Konzeption, Pla-nung und Umsetzung von Automatisierungslösungen. In Europa besitzt Yokogawa einen eigenen Vertrieb sowie eige-ne Service- und Engineering-Organisationen. Yokogawa Europe B.V. wurde 1982 als Zentrale für Europa in Amers-foort, NL, gegründet.
Yokogawa Deutschland GmbH
Broichhofstr. 7-11
40880 Ratingen
Telefon: +49 (2102) 4983-0
Telefax: +49 (2102) 4983-22
http://www.yokogawa.com/de
Telefon: +49 (2102) 4983-134
E-Mail: chantal.guerrero@de.yokogawa.com
![]()
