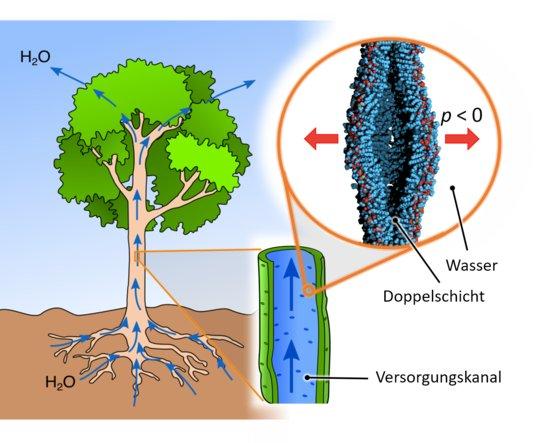
Hydraulische Systeme nutzen Druckunterschiede zur Signal-, Kraft- und Energieübertragung. Etliche Maschinen funktionieren auf Basis dieses Prinzips – aber auch in der Natur findet sich dafür ein prominentes Beispiel: die Wasseraufnahme von Pflanzen. Die Saugkraft der Wurzeln beruht dabei auf dem Unterdruck in den pflanzlichen Versorgungskanälen, der durch die Wasserverdunstung an den Zellwänden der Blätter entsteht.
Das pflanzliche Hydrauliksystem nennen Experten „Xylem“ – ein Zellgewebe durchzogen von winzigen Leitungsbahnen, in denen Wasser und Mineralstoffe durch die Pflanze fließen. Der Unterdruck liegt in diesem Netzwerk typischerweise irgendwo zwischen minus 5 und minus 50 bar. Die stärksten Unterdrücke von etwa minus 80 bar erreichen Wüstenpflanzen. Weshalb aber die Grenze von etwa minus 100 bar in der Regel nicht unterschritten wird, darauf gab es bisher keine schlüssige Antwort. Denn: Physikalische Gründe schienen grundsätzlich nicht gegen stärkere Unterdrücke zu sprechen. Und für die Pflanze wäre eine höhere Saugkraft von Vorteil, könnte sie doch effektiver Wasser aus trockenen Böden ziehen.
Ein interdisziplinäres Forscherteam aus Botanikern und Physikern des Jožef-Stefan Instituts in Ljubljana, des Max-Planck-Instituts für Kolloid und Grenzflächenforschung in Potsdam, der Freien Universität Berlin, der Universität Ulm, der Technischen Universität Darmstadt und der California State University Fullerton, USA, hat nun eine Erklärung geliefert: Mit Hilfe von Simulationen auf atomarer Ebene konnten die Wissenschaftler zeigen, dass offenbar wasserunlösliche Naturstoffe, sogenannte Lipide, in den Pflanzenflüssigkeiten für das Phänomen verantwortlich sind. Bei Unterdruck sorgen sie für die Bildung schnell expandierender Hohlräume – Fachleute sprechen von Kavitäten. Werden sie zu groß, reißt die Wassersäule ab. Die Stärke der maximal tolerierbaren Unterdrücke wird dadurch dramatisch reduziert, von mehr als minus 1000 bar in reinem Wasser auf weniger als minus 100 bar in den Pflanzensäften. Der Wert, den die Modelle vorhersagen, stimmt mit den stärksten in der Botanik gemessenen Unterdrücken hervorragend überein, berichten die Forscher.
Lipide dienen in lebenden Organismen hauptsächlich als Strukturkomponenten in Zellmembranen, als Energiespeicher oder als Signalmoleküle. Aus jüngeren biochemischen Untersuchungen weiß man, dass solche Lipide auch im pflanzlichen Gefäßsystem vorkommen – besonders solche, die in einer wässrigen Lösung Doppelschichten bilden. Aus chemischer Sicht beruht dieses Verhalten auf den zwei vollkommen unterschiedlichen Enden der Lipide: Das eine stößt Wassermoleküle ab, das andere zieht sie an. Experten sprechen von hydrophil (wasseranziehend) und hydrophob (wasserabstoßend). Die hydrophile Kopfgruppe wendet sich also nach außen zum Wasser hin, während der hydrophobe Schwanz sich mit einem gleichartigen Ende eines anderen Lipids zusammenlagert. Solche Lipidpaare ordnen sich dann gewissermaßen in Reih und Glied an und bilden eine sogenannte Lipiddoppelschicht nach Art der Zellmembranen.
In ihrer Arbeit kombinierten die Forscher umfangreiche atomistische Computersimulationen der Molekulardynamik mit Modellrechnungen zur Entstehungsrate von Kavitäten. Damit konnten sie aus mikroskopischen Vorgängen Aussagen zum Verhalten auf biologisch relevanten Längen- und Zeitskalen treffen. „Durch die temperaturbedingten zufälligen Bewegungen von Wassermolekülen bilden sich in der Flüssigkeit regelmäßig winzige Hohlräume“, erklärt Philip Loche, Doktorand am Fachbereich Physik der Freien Universität Berlin. Die Kohäsionskräfte des Wassers sorgen aber in der Regel dafür, dass sich diese rasch wieder schließen. „Die Moleküle in Flüssigkeiten kleben gewissermaßen zusammen – anders als in einem Gas“, veranschaulicht Loche. Aus diesem Grund widerstehen Wassersäulen vergleichsweise hohen Zugkräften, ohne sich abzutrennen. Die Anwesenheit der Lipiddoppelschichten bewirkt nun allerdings, dass deutlich einfacher Hohlräume entstehen können, die rasch anwachsen, statt sich wieder aufzulösen. „Vereinfacht ausgedrückt ist es viel leichter zwei Lipidschichten auseinanderzureißen als eine Gruppe von Wassermolekülen“, erklärt Emanuel Schneck, Professor an der Technischen Universität Darmstadt und bis vor kurzem noch Forscher am Max-Planck-Instituts für Kolloid und Grenzflächenforschung in Potsdam.
Die Simulationen offenbarten, dass sich auf Grund der Lipidaggregate bei Unterdrücken von mehr als minus 100 bar sehr häufig Kavitäten formen. Bei den in Pflanzen typischerweise vorherrschenden Unterdrücken von minus 5 bis minus 50 bar passiert das hingegen so gut wie nie. Die Forscher stellten außerdem fest, dass kleine, wasserlösliche Bestandteile des Pflanzensaftes kaum die Bildung von Kavitäten begünstigen. Offenbar beruht also das in der Pflanzenwelt beobachtete Drucklimit tatsächlich auf den zusammengelagerten Lipiden. „Unsere Ergebnisse liefern zum ersten Mal eine plausible Erklärung dafür, weshalb Unterdrücke von mehr als minus 100 bar von Pflanzen nicht lange aufrechterhalten werden können“, so Schneck. Da Pflanzen also nicht beliebig stark Wasser aus dem Boden saugen können, schränkt dies die Fähigkeit der Pflanzen ein, Wasser aus dem trocknenden Boden aufzunehmen und letztendlich, wo Pflanzen überleben und wachsen können.
Matej Kanduč, Physiker am Jožef Stefan Institute in Ljubljana, Slowenien und Erstautor der Studie, merkt an, dass die Ergebnisse auch im Zusammenhang mit dem Klimawandel von Interesse seien. „Die größten negativen Drücke in Pflanzen findet man in Gegenden, wo Wasserknappheit herrscht“, berichtet er. Und bedingt durch den Klimawandel trocknen in immer mehr Regionen der Erde die Böden aus. „Wasser muss dort gegen den größten Widerstand aus dem Boden gezogen werden“, so Kanduč.
Max-Planck-Institut für Kolloid- und Grenzflächenforschung
Am Mühlenberg 1 im Potsdam Science Park
14476 Potsdam
Telefon: +49 (331) 567-7814
Telefax: +49 (331) 567-7875
http://www.mpikg.mpg.de
Max-Planck-Institut für Kolloid- und Grenzflächenforschung
Telefon: +49 (331) 567-9203
Fax: +49 (331) 567-9202
E-Mail: katja.schulze@mpikg.mpg.de
![]()
